ΠΡΟΣΟΧΗ ΕΟΦ: Ανάκληση συμπληρωμάτων διατροφής

Έχοντας υπόψη:
1. Το άρθρο 6, παρ.ΙΙ του Ν. 1316/83 (ΦΕΚ 3 Α΄) «Ίδρυση, οργάνωση και αρμοδιότητες του Ε.Ο.Φ.», όπως αντικαταστάθηκε με το άρθρο 25 του Ν. 3730/2008 (ΦΕΚ 262 Β΄)
2. Τις διατάξεις της υπ’ αριθ. Υ1/Γ.Π.127962/03/27.2.2004 ΚΥΑ (ΦΕΚ 395 Β)
3. Τα υπ’ αριθ. 67722/13.9.2016 και 67723/13.9.2016 έγγραφα του ΕΦΕΤ για ενημέρωση μέσω του Συστήματος Έγκαιρης Προειδοποίησης για τα Τρόφιμα και τις Ζωοτροφές (RASFF)
ΑΠΟΦΑΣΙΖΟΥΜΕ
Την ανάκληση των παρτίδων 14329 030 ΝΤ και 14315 030 ΝΤ του προϊόντος Iron Pump Pre-Working Muscle Formula, λόγω παρουσίας του μη εγκεκριμένου νεοφανούς τροφίμου (novel food) σαν συστατικό Agmatine Sulphate. Το προϊόν παράγεται στις ΗΠΑ από την εταιρεία Musclepharm Corp, και διακινήθηκε από την εταιρεία Prometeus Sport B.V., Ολλανδίας. Διακινείται σαν συμπλήρωμα διατροφής. Η παρούσα απόφαση αποτελεί προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας. Οι εταιρείες που είναι υπεύθυνες για τη διακίνηση του προϊόντος στην Ελλάδα οφείλουν να επικοινωνήσουν άμεσα με τους πελάτες τους, προκειμένου να το αποσύρουν από την αγορά, ενημερώνοντας σχετικά τον ΕΟΦ.
Τα σχετικά παραστατικά πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
2. Ανάκληση παρτίδων του συμπληρώματος διατροφής Mr.Hyde
Έχοντας υπόψη:
1. Το άρθρο 6, παρ.ΙΙ του Ν. 1316/83 (ΦΕΚ 3 Α΄) «Ίδρυση, οργάνωση και αρμοδιότητες του Ε.Ο.Φ.», όπως αντικαταστάθηκε με το άρθρο 25 του Ν. 3730/2008 (ΦΕΚ 262 Β΄)
2. Τις διατάξεις της υπ’ αριθ. Υ1/Γ.Π.127962/03/27.2.2004 ΚΥΑ (ΦΕΚ 395 Β)
3. Το υπ’ αριθ. 67721/13.9.2016 έγγραφο του ΕΦΕΤ για ενημέρωση μέσω του Συστήματος Έγκαιρης Προειδοποίησης για τα Τρόφιμα και τις Ζωοτροφές (RASFF)
ΑΠΟΦΑΣΙΖΟΥΜΕ
Την ανάκληση του συμπληρώματος διατροφής Mr.Hyde, στις παρτίδες και γεύσεις του παρακάτω πίνακα λόγω παρουσίας της μη εγκεκριμένου νεοφανούς τροφίμου Agmatine Sulphate, των νεοφανών τροφίμων σαν συστατικά Creatine nitrate, Rauwoifia Vomitoria root extract και της μη εγκεκριμένης ουσίας L-cytrulline aspartate καθώς και παράγωγα της ουσίας phenethylamine.
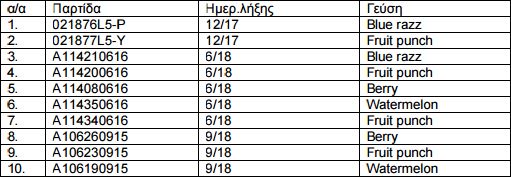
Το προϊόν διακινείται σαν συμπλήρωμα διατροφής παράγεται στις ΗΠΑ και διανεμήθηκε από την Prometeus sport B.V., Ολλανδίας. Η παρούσα απόφαση αποτελεί προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας. Οι εταιρείες που είναι υπεύθυνες για τη διακίνηση των παρτίδων του προϊόντος στην Ελλάδα οφείλουν να επικοινωνήσουν άμεσα με τους πελάτες τους, προκειμένου να το αποσύρουν από την αγορά, ενημερώνοντας σχετικά τον ΕΟΦ.
Τα σχετικά παραστατικά πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
3.Ανάκληση της παρτίδας 15-0114W-1 του συμπληρώματος διατροφής Organic Wheatgrass tablets
Έχοντας υπόψη:
1. Το άρθρο 6, παρ.ΙΙ του Ν. 1316/83 (ΦΕΚ 3 Α΄) «Ίδρυση, οργάνωση και αρμοδιότητες του Ε.Ο.Φ.», όπως αντικαταστάθηκε με το άρθρο 25 του Ν. 3730/2008 (ΦΕΚ 262 Β΄)
2. Τις διατάξεις της υπ’ αριθ. Υ1/Γ.Π.127962/03/27.2.2004 ΚΥΑ (ΦΕΚ 395 Β)
3. Τo υπ’ αριθ. 67588/12.9.2016 έγγραφο του ΕΦΕΤ για ενημέρωση μέσω του Συστήματος Έγκαιρης Προειδοποίησης για τα Τρόφιμα και τις Ζωοτροφές (RASFF)
ΑΠΟΦΑΣΙΖΟΥΜΕ
Την ανάκληση της παρτίδας 15-0114W-1 του συμπληρώματος διατροφής Organic Wheatgrass tablets, λόγω ανίχνευσης του παθογόνου μικροοργανισμού Escherichia coli –shigatoxin. Το προϊόν παράγεται από την εταιρεία HANOJU Deutschland GmbH και διακινείται από την εταιρεία Mipana EZ Szafarz sp. Jawna, Πολωνίας σαν συμπλήρωμα διατροφής. Η παρούσα απόφαση αποτελεί προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας. Οι εταιρείες που είναι υπεύθυνες για τη διακίνηση του προϊόντος στην Ελλάδα οφείλουν να επικοινωνήσουν άμεσα με τους πελάτες τους, προκειμένου να το αποσύρουν από την αγορά, ενημερώνοντας σχετικά τον ΕΟΦ.
Τα σχετικά παραστατικά πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Πηγή: eof.gr















